大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
2025年8月7日,美国圣路易斯华盛顿大学医学院Grant A.Challen 团队在《Cell Stem Cell》期刊发表题为“Non-canonical functions of DNMT3A in hematopoietic stem cells regulate telomerase activity and genome intergrity”(DNMT3A调控造血干细胞的端粒酶活性和基因组完整性的非经典功能)的重要研究文章。
研究通过构建DNA甲基化功能丧失但蛋白结构完整的Dnmt3a点突变小鼠模型(E752A、V712G、R832A突变),结合体内外功能实验、连续骨髓移植、全基因组重亚硫酸盐测序(WGBS)及端粒功能分析等研究,系统揭示了DNMT3A在造血干细胞(HSC)中存在不依赖于其DNA甲基转移酶活性的非经典功能,核心结论为Dnmt3a缺失的HSC通过上调端粒酶活性、维持端粒长度并抑制DNA损伤应答(DDR),实现无限移植传代,而保留催化缺失蛋白的HSC则无法长期维持该优势。综上,这些发现阐明了DNMT3A在HSCs中具有不依赖于其经典甲基化功能的、调控端粒稳态和基因组完整性的“非经典”作用,为理解克隆性造血(CH)和白血病中DNMT3A突变的作用机制提供了全新视角。

英文标题:Non-canonical functions of DNMT3A in hematopoietic stem cells regulate telomerase activity and genome intergrity
中文标题:DNMT3A调控造血干细胞的端粒酶活性和基因组完整性的非经典功能
发表时间:2025-8-7
发表期刊:Cell Stem Cell
影响因子:IF20.4/Q1
技术平台:WGBS、RNA-seq等
作者单位:美国圣路易斯华盛顿大学医学院
DOI:10.1016/j.stem.2025.06.010
DNMT3A是造血干细胞(HSC)命运决定的关键调控因子,也是人类克隆性造血(CH)中最常突变的基因。DNMT3A作为一种DNA甲基转移酶,在先前研究中,DNMT3A功能丧失细胞仅表现出轻度DNA甲基化变化,且与基因表达变化不相关。为探索Dnmt3a在HSC中是否具有DNA甲基化非依赖性功能,研究人员构建了多个DNA甲基化功能丧失不同程度的Dnmt3a等位基因突变小鼠模型。分析结果发现,DNA甲基化功能丧失的Dnmt3a蛋白可以挽救Dnmt3a缺失型HSC的克隆扩增,表明Dnmt3a在HSC中具有重要的非经典功能。Dnmt3a缺失型HSC能够无限期移植,表明其能规避抑制HSC复制寿命的机制(如端粒缩短)。Dnmt3a缺失型HSC显示出增强的端粒酶活性,并在连续移植中维持端粒长度,揭示了DNMT3A突变在调控HSC寿命中与DNA甲基化功能无关的全新作用。
研究亮点
- 构建小鼠模型以研究Dnmt3a不依赖DNA甲基化的功能
- Dnmt3a介导的DNA甲基化对造血干细胞分化至关重要,但对自我更新并非必需
- Dnmt3a调控造血干细胞中端粒酶的表达和活性
- 在端粒酶缺失情况下,Dnmt3a影响造血干细胞中的DNA损伤应答信号
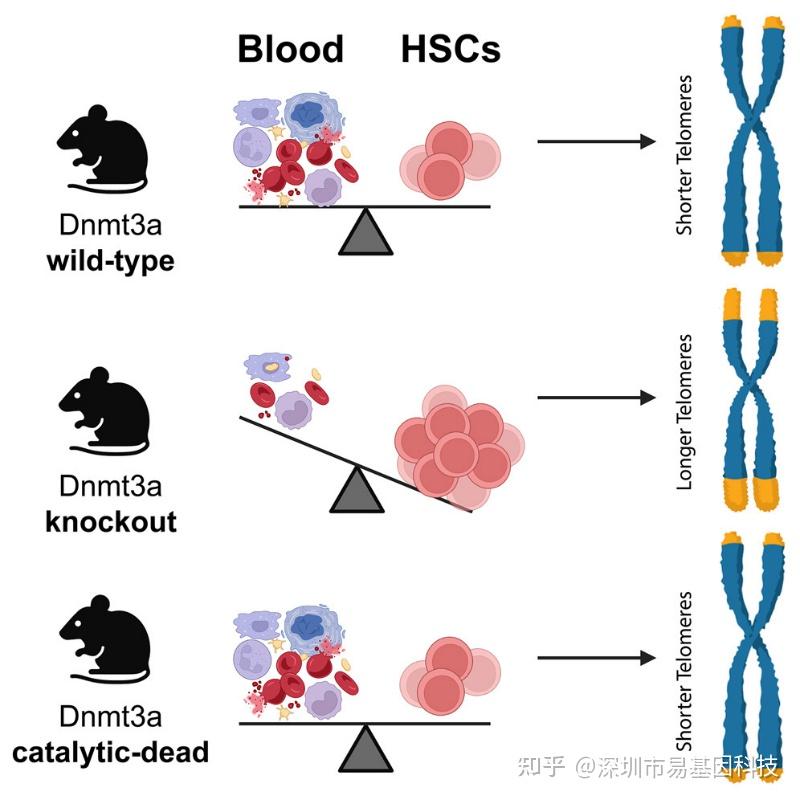
图形摘要
研究方法
(1)小鼠模型构建:
- 构建条件性敲除(Dnmt3afl/fl),催化失活点突变(催化死亡/0%甲基化活性的Dnmt3aE752A、活性30%的Dnmt3aV712G和靶标识别缺陷/20%活性的Dnmt3aR832A),Dnmt3a/Terc双敲除(DTKO)模型。
(2)造血干细胞功能学分析:
- 连续骨髓移植:评估HSCs长期自我更新和重建能力。
- 集落形成单位(CFU)实验:体外评估HSCs/祖细胞增殖功能。
- 流式细胞术分析与分选:精确分选和鉴定HSCs(Lin- Sca-1+ c-Kit+ CD48- CD150+)及其他造血细胞群体,并分析细胞凋亡(Annexin V)、细胞周期(Ki-67/DAPI)和DNA损伤(γH2AX)。
(3)分子机制分析
- 全基因组甲基化测序(WGBS):在全基因组单碱基分辨率水平上,系统比较不同基因型HSCs和骨髓细胞的DNA甲基化图谱,是本研究核心的甲基化分析技术。
- RNA测序(RNA-seq)与qPCR:分析转录组变化和特定基因(如Tert, Terc)的表达。
(4)端粒功能分析
- 端粒限制性片段(TRF)分析:检测端粒DNA片段的大小分布,反映平均端粒长度。
- 端粒酶活性检测(TRAP法):定量检测端粒延伸产物,定量端粒酶活性。
- 端粒荧光原位杂交(TelC FISH):定量检测单个细胞的端粒信号强度。
(5)DNA损伤与ALT分析:
- 彗星试验分析全局DNA损伤。
- 免疫荧光共定位(53BP1/TRF1)检测端粒功能障碍诱导的灶(TIF)。
- C-circle检测和APB(ALT相关PML核体)分析评估替代性端粒延长(ALT)通路。
(6)蛋白表达及互作分析:通过免疫共沉淀(Co-IP)研究Dnmt3a与组蛋白伴侣SPT16的相互作用。 - 蛋白质免疫印迹(Western Blot):分析目标蛋白(如Dnmt3a, γH2AX, SPT16)的表达水平。
- 免疫共沉淀(Co-IP):研究Dnmt3a与潜在互作蛋白(如SPT16)的互作及其药物干预下的变化。
结果图形
(1)Dnmt3a在造血中存在非DNA甲基化依赖性功能的证据
研究团队首先通过过表达实验揭示Dnmt3a存在区别于其传统甲基化酶活性的功能。由于DNMT3L(可增强Dnmt3a甲基化活性的辅助因子)在HSC中不表达,研究团队在野生型和Dnmt3a敲除(Dnmt3aKO)HSPC中分别异位表达Dnmt3L,观察到Dnmt3L仅在野生型背景下抑制移植嵌合率,而在Dnmt3aKO细胞中无影响(图1C-E),说明其功能依赖Dnmt3a。更重要的是,过表达野生型Dnmt3a对野生型和Dnmt3aKO HSPC均产生毒性,导致移植后细胞快速凋亡(图1B、F),而Dnmt3L过表达虽引起更显著的DNA高甲基化(图1G-H),却未产生同等毒性,表明Dnmt3a的某些调控作用不依赖于其催化活性。WGBS分析显示,Dnmt3a过表达仅引起轻度甲基化改变,而Dnmt3L导致数千个差异甲基化区域(DMRs)高甲基化,但表型差异却显著差异,这表明Dnmt3a功能不能简单直接等同于其甲基化活性,可能存在独立于催化的非经典功能。
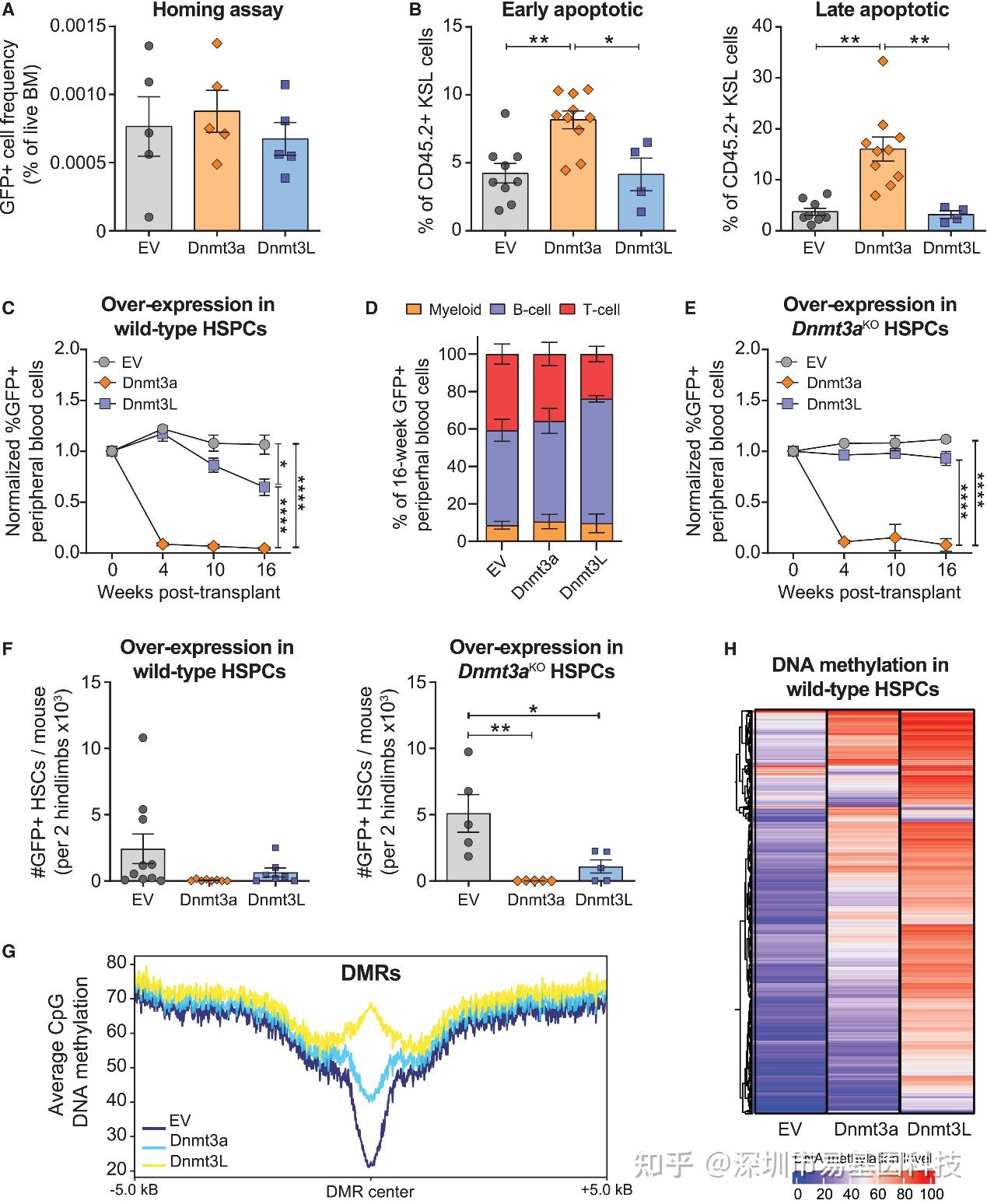
图1:Dnmt3a在造血中DNA甲基化非依赖性功能的证据
(2)DNA甲基化功能丧失的Dnmt3a蛋白可挽救Dnmt3a缺失HSCs的功能变化
为直接验证非经典功能,研究者利用慢病毒在Dnmt3aKO HSC中挽救表达野生型或催化缺失型Dnmt3a点突变体(E752A、V712G、R832A)。分析结果表明,在Dnmt3aKO HSCs中挽救这些甲基化功能受损的突变蛋白,能够像挽救野生型Dnmt3a一样,抑制其增强的CFU形成能力,且所有三种催化缺陷变体同样能有效挽救CFU异常(图2A),但并未介导全基因组DNA甲基化显著增加(图2B)。这直接证明,挽救Dnmt3aKO HSCs异常增殖表型的功能,不依赖于Dnmt3a的DNA甲基化催化活性。
体内移植实验中,全骨髓细胞移植显示Dnmt3aE752A/E752A和Dnmt3aR832A/R832A HSC在二次移植后逐渐衰竭,而Dnmt3aKO HSC持续扩增(图2C-E),提示甲基化非依赖功能虽能短期调控HSC活性,但长期维持克隆优势需完全丧失Dnmt3a蛋白。
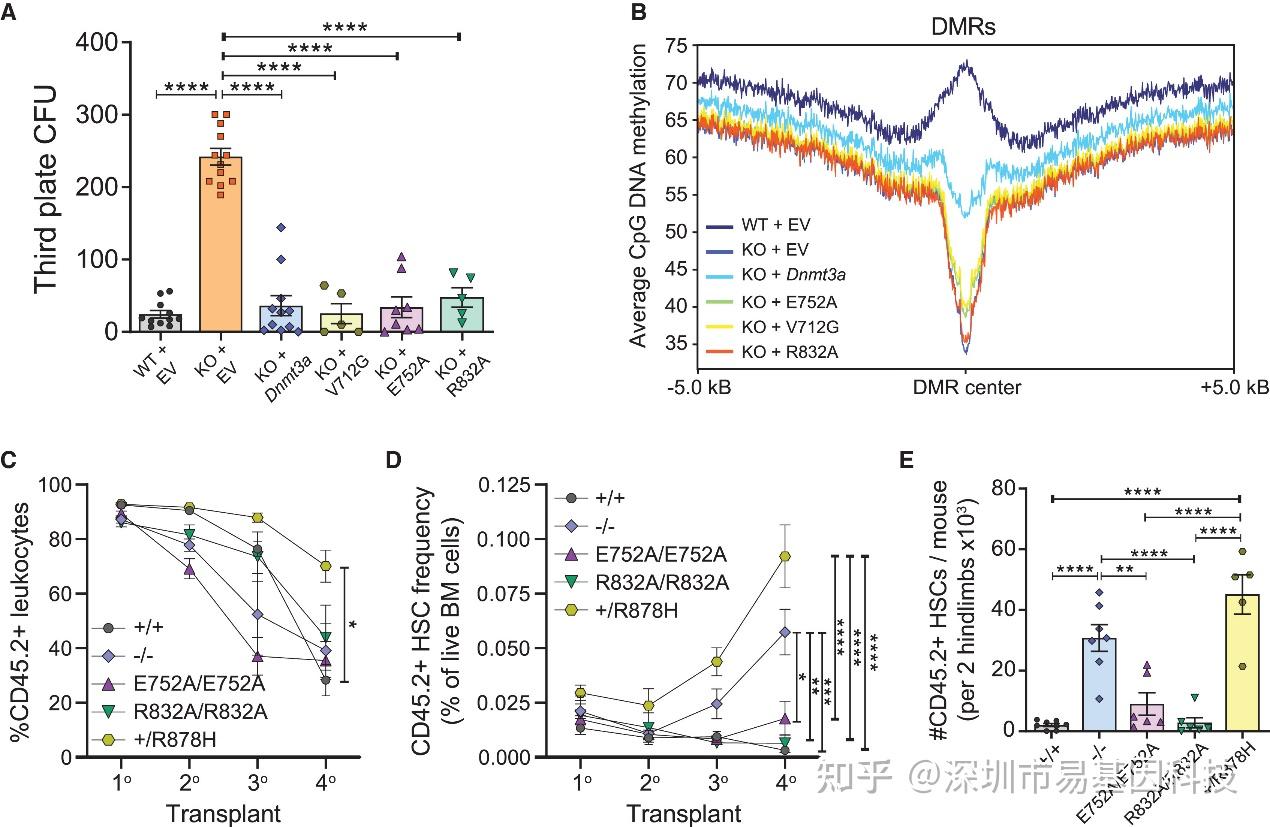
图2:DNA甲基化功能丧失的Dnmt3a蛋白挽救Dnmt3a缺失型造血干细胞的功能改变
(3)DNA甲基化缺失型Dnmt3a可挽救Dnmt3a缺失HSCs在连续移植中的克隆扩增
为在体内验证,研究团队在成年小鼠中诱导表达纯合或杂合的催化失活Dnmt3a突变蛋白(Δ/E752A, Δ/R832A)。在连续竞争性移植实验中,完全缺失Dnmt3a(Δ/Δ)的HSCs表现出经典且持续的克隆扩增优势,但在表达催化失活突变体(Δ/E752A, Δ/R832A)的HSCs中,其过度自我更新的表型被显著抑制,功能上更接近于野生型或杂合缺失(Δ/+)的HSCs(图3A-C)。这再次证明Dnmt3a调控HSCs自我更新的关键功能不依赖于其DNA甲基化活性。
值得注意的是,WGBS分析显示Dnmt3aΔ/E752A与Dnmt3aΔ/Δ细胞的甲基化谱几乎完全重叠。此结果强烈证明,HSC的长期克隆扩增优势与DNA甲基化状态(催化活性丧失)不相关,而完全依赖于Dnmt3a蛋白的缺失。细胞周期和凋亡分析排除这些差异源于增殖或存活率变化(图3D-E),证实功能差异主要归因于其内在自我更新机制变化。
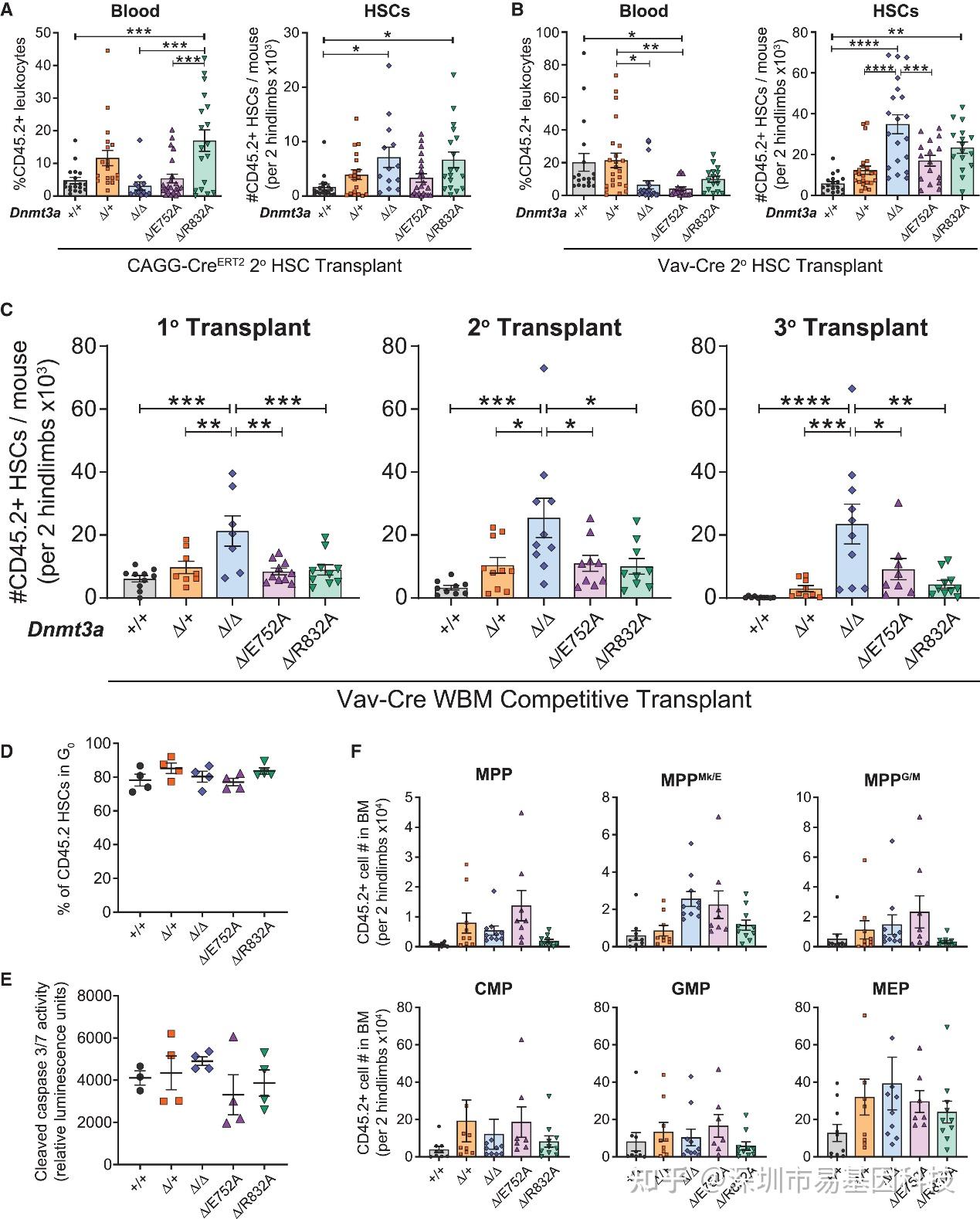
图3:DNA甲基化功能丧失的Dnmt3a挽救连续移植中Dnmt3a缺失型造血干细胞的克隆扩增
(4)DNA甲基化与基因表达和功能输出不相关
研究者对来自连续移植后的不同基因型HSCs和骨髓细胞进行了单碱基分辨率的全基因组甲基化测序分析(WGBS)。分析结果显示,Dnmt3aΔ/E752A(催化失活)细胞的整体甲基化谱与Dnmt3a Δ/Δ(完全缺失)细胞几乎完全重叠,而与野生型细胞显著不同(图4A-F)。其中主成分分析(PCA)显示,在Dnmt3aKO细胞中的差异甲基化区域(DMRs),Dnmt3aΔ/E752A细胞也表现出几乎一致的甲基化水平(图4C, F)。然而,与几乎完全一致的甲基化图谱形成鲜明对比的是,这些基因型在HSC功能(自我更新)和基因表达谱上存在显著差异。RNA-seq分析显示,Δ/E752A和Δ/R832A HSCs的转录组更接近于野生型,而与Δ/Δ HSCs存在显著差异(图4G, H)。
研究通过整合WGBS与RNA-seq数据,系统论证了DNA甲基化变化不能预测HSC功能潜力,甲基化非依赖的蛋白-蛋白互作或染色质调控才是驱动表型的核心机制,为研究领域长期存在的"甲基化悖论"提供了决定性证据。
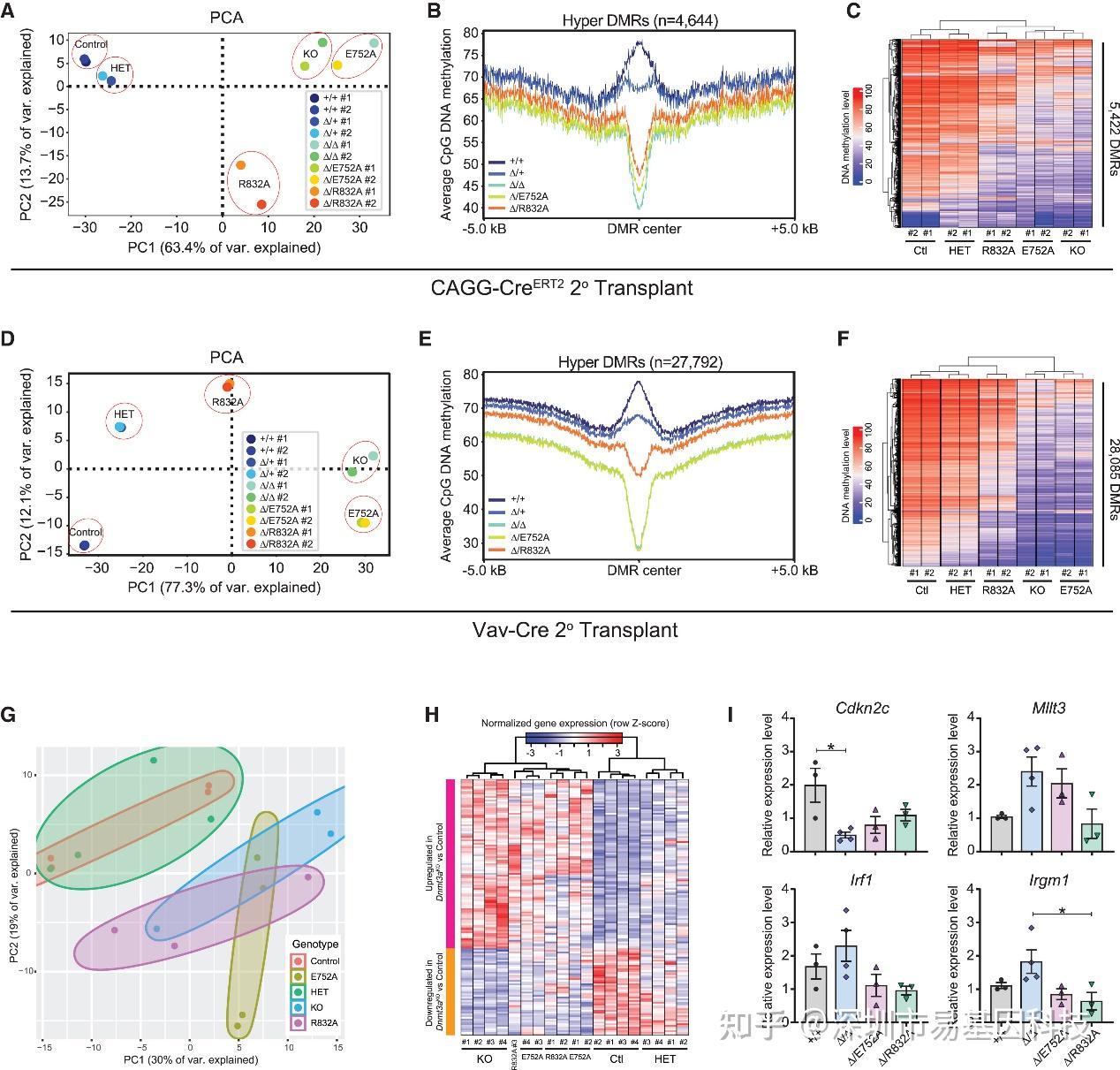
图4:造血干细胞的DNA甲基化谱与基因表达及功能输出无关
(5)DNMT3A功能丧失增强TERT表达和端粒酶活性
研究者观察到Dnmt3aKO HSCs能够进行无限期连续移植,提示其可能规避了限制HSC复制寿命的机制,研究团队聚焦端粒调控机制。TRF Southern blot分析和TelC FISH证实,Dnmt3aKO骨髓细胞和HSPCs的端粒长度显著长于对照组,且在连续移植中得以维持(图5A-C)。qPCR和TRAP实验揭示,Dnmt3aΔ/Δ细胞Tert mRNA表达增加3倍,端粒酶活性显著升高(图5D-E)。重要的是,这种端粒酶的上调也出现在催化失活的Δ/E752A和Δ/R832A HSCs中(图5G-H),并且这些细胞的端粒在短期(二次)移植后也出现延长(图5I),然而在长期移植(四次)后,E752A和R832A组端粒长度不及Dnmt3aΔ/Δ组(图5J),提示短期端粒酶激活可能依赖甲基化非直接机制(如转录调控),而长期维持需完全蛋白缺失以激活替代性端粒延长(ALT)通路。
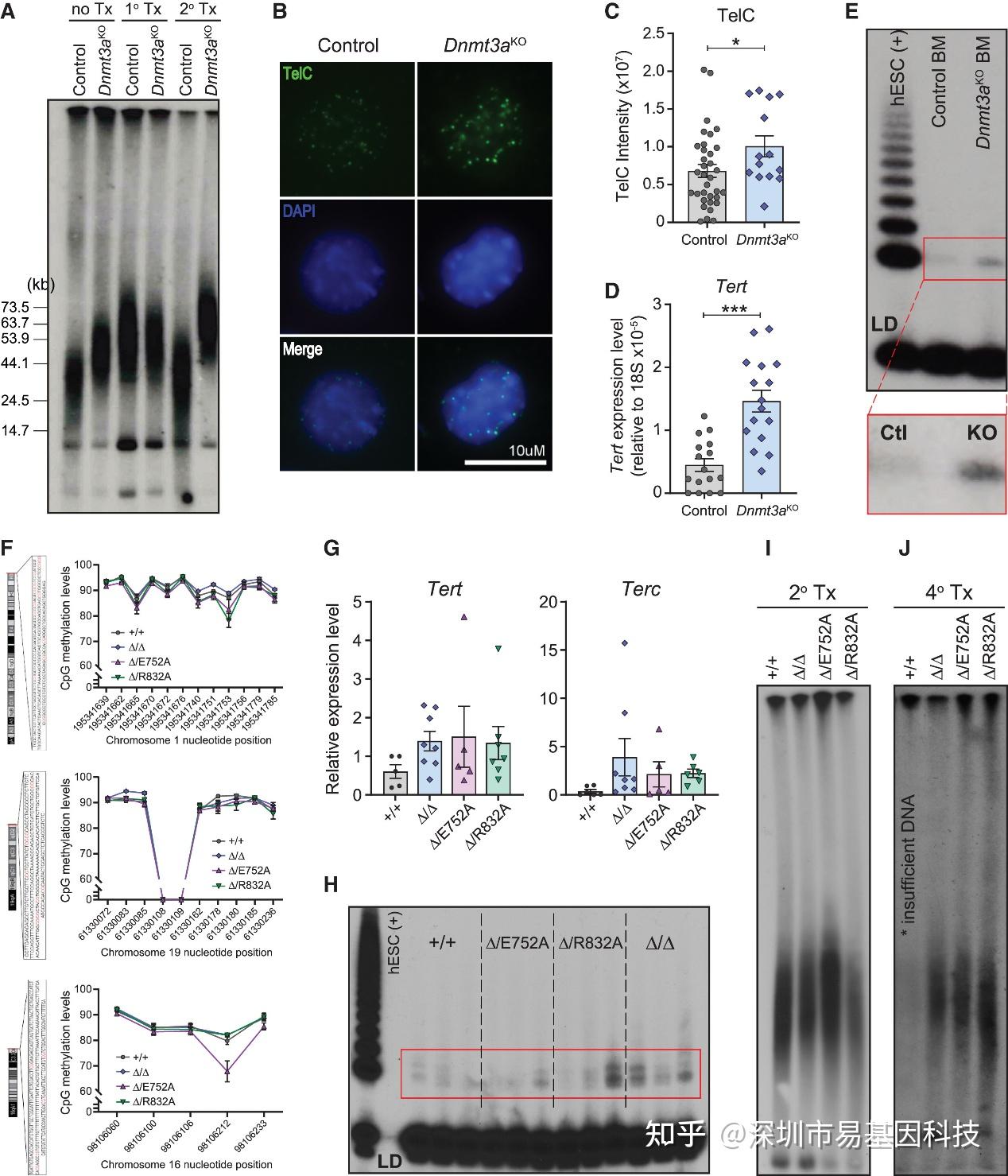
图5:DNMT3A功能丧失会增强TERT表达和端粒酶活性
(6)Dnmt3a功能丧失可部分挽救端粒酶缺失HSCs的功能
为了探究端粒酶上调是否是Dnmt3aKO HSCs功能优势的原因,研究者构建了Dnmt3a与Terc(端粒酶RNA组分)双敲除(DTKO)小鼠。在连续移植中,单纯的TercKO HSCs由于端粒快速缩短,其重建功能急剧减弱,但DTKO HSCs的移植能力得到了显著的部分挽救(图6A-D)。
有趣的是,尽管DTKO细胞缺乏端粒酶活性(图6F),但其端粒在连续移植后仍被延长(图6E),并出现了替代性端粒延长(ALT)通路标志物C-circle和APBs(图6I-K)。这表明,在端粒酶缺失的情况下,Dnmt3a缺失能够激活ALT通路来维持端粒长度,从而部分补偿端粒酶功能。
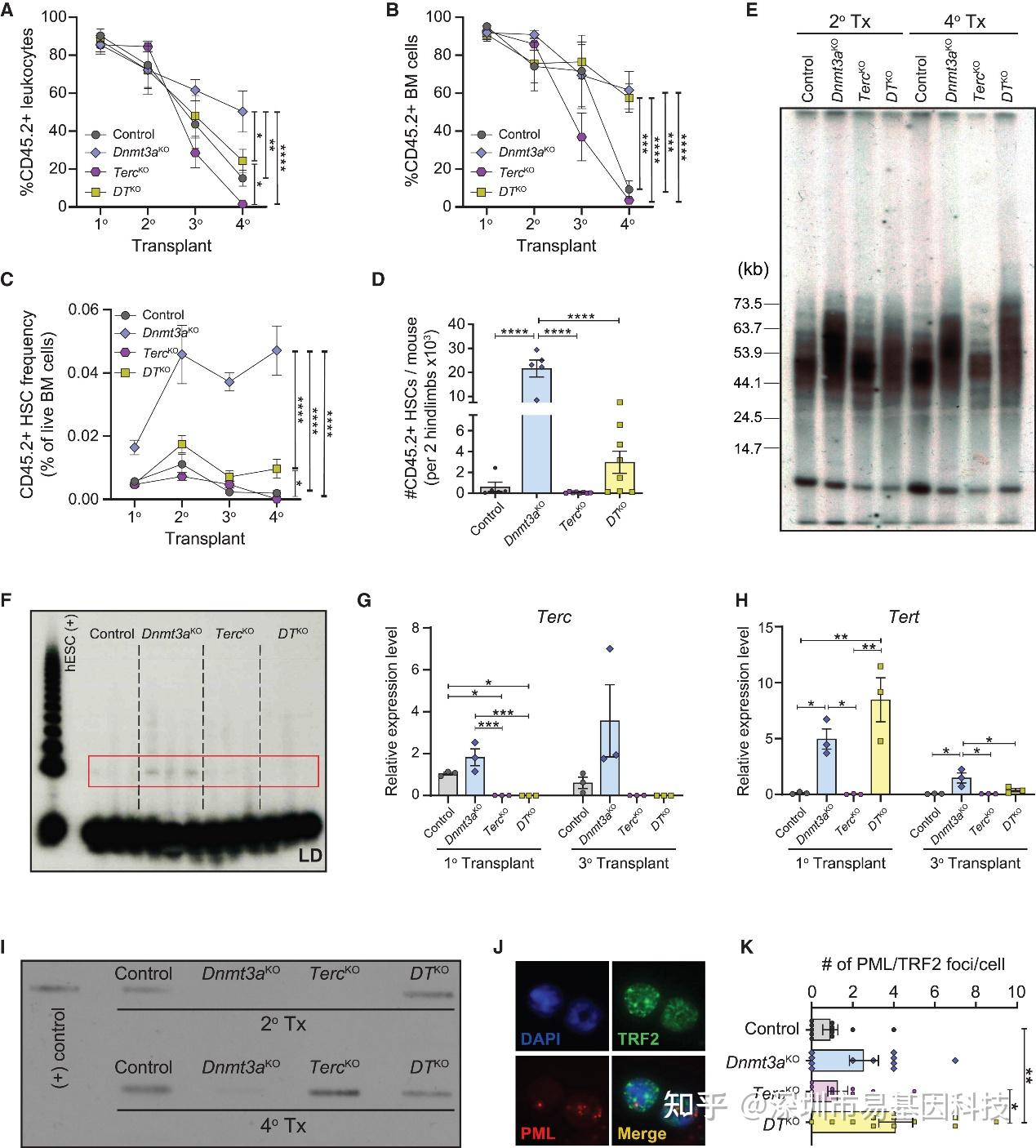
图6:Dnmt3a功能丧失部分挽救端粒酶缺失HSCs的功能缺陷
(7)Dnmt3a缺失抑制功能失调端粒处的DNA损伤应答
端粒功能障碍会激活DNA损伤应答(DDR),导致细胞衰老或凋亡。研究发现,在TercKO HSCs中,DDR标志物γH2AX水平、端粒功能障碍诱导灶(TIF)以及凋亡均显著增加。而同时缺失Dnmt3a(DTKO)能显著抑制这些DDR信号的激活(图7A-F)。彗星试验也表明DTKO细胞的整体DNA损伤少于TercKO细胞(图7G-H)。
此外,在基因毒性药物处理下,Dnmt3aKO细胞也表现出更强的DDR抵抗,而这种抵抗在催化失活突变体(Δ/E752A, Δ/R832A)中减弱或消失(图7I)。提示Dnmt3a通过非甲基化依赖性方式整合并调控HSCs对基因毒应激(特别是端粒损伤)的DDR信号。
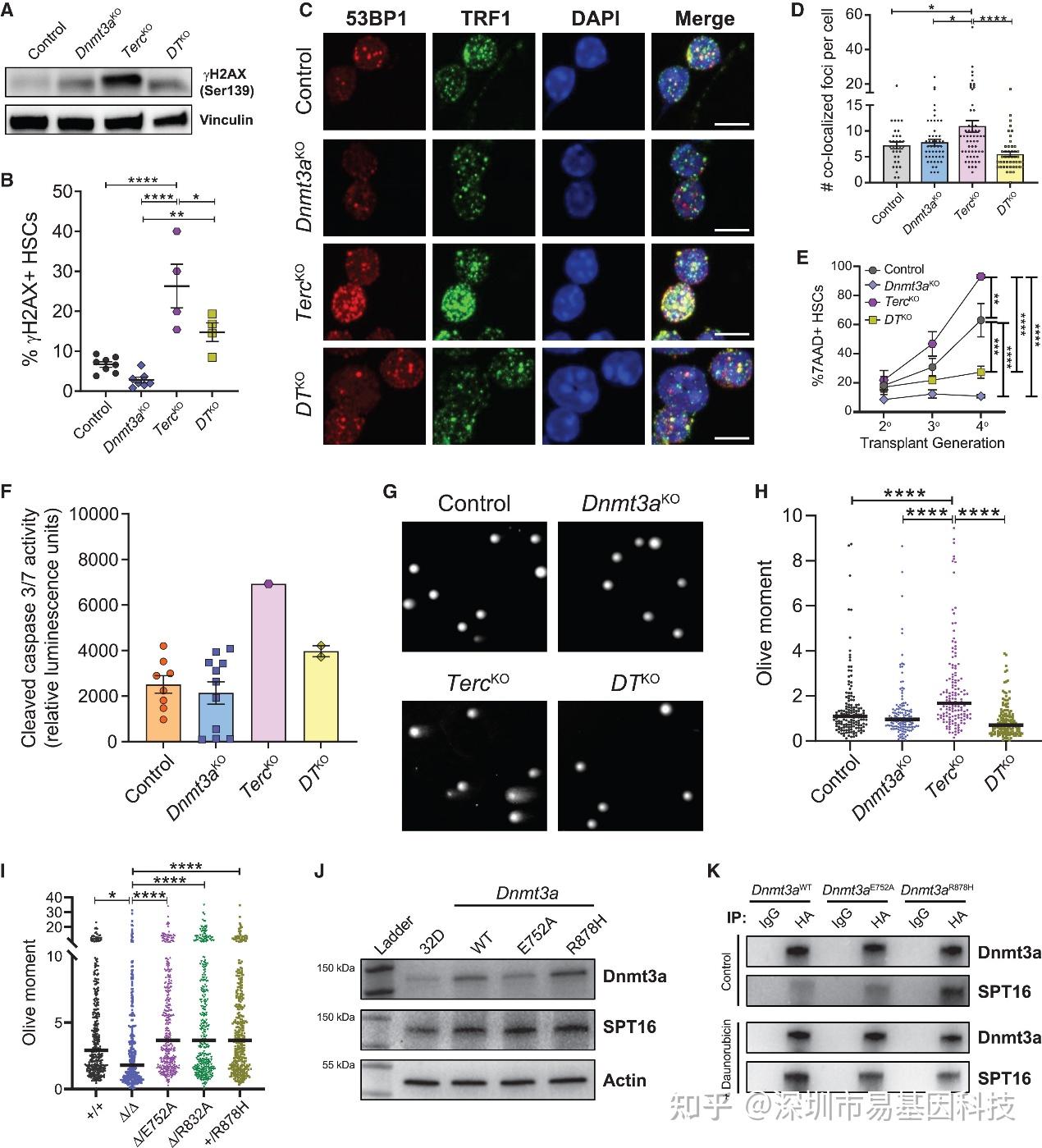
图7:Dnmt3a丧失抑制功能失调端粒处的DDR
结论和启示
本研究通过一系列功能实验和分子机制实验(WGBS、RNA-seq)等揭示DNMT3A除了具有经典的DNA甲基化功能外,在造血干细胞中还具有至关重要的“非经典”功能:DNMT3A可以作为端粒酶活性和端粒长度的负调控因子,并通过抑制DNA损伤反应来维护基因组完整性。DNMT3A功能缺失突变通过解除这些抑制,使HSCs获得端粒维持和抗DNA损伤的双重能力,从而驱动其克隆性扩增,这可能是其作为血液肿瘤驱动突变的核心机制。
在本研究中,DNA甲基化分析(WGBS)并非为了寻找致病性的甲基化差异,而是通过比较催化失活突变与完全敲除的甲基化图谱,排除功能差异并非源于甲基化差异,从而将研究焦点转向非甲基化机制。这是DNA甲基化乃至表观遗传学研究思路中的一个优秀案例。
关于易基因全基因组重亚硫酸盐测序(WGBS)
全基因组重亚硫酸盐甲基化测序(WGBS)可以在全基因组范围内精确的检测所有单个胞嘧啶碱基(C碱基)的甲基化水平,是DNA甲基化研究的金标准。WGBS能为基因组DNA甲基化时空特异性修饰的研究提供重要技术支持,能广泛应用在个体发育、衰老和疾病等生命过程的机制研究中,也是各物种甲基化图谱研究的首选方法。
易基因全基因组甲基化测序技术通过T4-DNA连接酶,在超声波打断基因组DNA片段的两端连接接头序列,连接产物通过重亚硫酸盐处理将未甲基化修饰的胞嘧啶C转变为尿嘧啶U,进而通过接头序列介导的 PCR 技术将尿嘧啶U转变为胸腺嘧啶T。
应用方向:
WGBS广泛用于各种物种,要求全基因组扫描(不错过关键位点)
- 全基因组甲基化图谱课题
- 标志物筛选课题
- 小规模研究课题
技术优势:
- 应用范围广:适用于所有参考基因组已知物种的甲基化研究;
- 全基因组覆盖:最大限度地获取完整的全基因组甲基化信息,精确绘制甲基化图谱;
- 单碱基分辨率:可精确分析每一个C碱基的甲基化状态。
| 技术类型 | 起始量 | 特点 | 覆盖度 |
|---|---|---|---|
| 常规WGBS | 1μg gDNA | 正常BS建库技术 | 95% |
| Micro DNA-WGBS | 1-10000个细胞/1ng基因组DNA | 在常规WGBS技术上进行技术改进,使得起始量大大降低,适合珍稀样本的研究 | 95% |
| scWGBS | 单细胞/1-10个细胞 | 克服了组织内部细胞异质性的影响,可以满足单个细胞层面的课题研究 | 20% |
| Micro DNA-XRBS | 1ng gDNA、单细胞 | 为Micro DNA-WGBS的简化版本,特别适用于大样本量的珍稀样本DNA甲基化研究 | 20M CG |
易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化、cfDNA)和表观转录组学(m6A、m5C、m1A、m7G、ac4C、RNA与蛋白互作)、DNA与蛋白互作及染色质开放性技术方案(ChIP-seq、ATAC-seq),更多表观组学或多组学研究可关注易基因公众号、网站、市场微信号等,期待与各位老师开展合作交流。
参考文献:
Xavier Raj I, …et al, Challen GA. Non-canonical functions of DNMT3A in hematopoietic stem cells regulate telomerase activity and genome integrity. Cell Stem Cell. 2025 Jul 10. doi: 10.1016/j.stem.2025.06.010.